【协和医学杂志】多发性骨髓瘤合并乳腺髓外浆细胞瘤1例并文献复习
时间:2025-09-07 12:09:53 来源 网络 作者:网络
病例简介
患者女性,58岁,因“持续性发热11 d”于2023年4月6日入住北京协和医院血液内科病房。
查血常规示正细胞、正色素性贫血合并白细胞计数减少;血清蛋白电泳(SPEP)检测示M蛋白比例40.2%,γ球蛋白比例42.1%;血液β2-微球蛋白(β2-MG)6.4 mg/L;血清游离轻链分析(FLC):sFLC-λ 345.0 mg/L,sFLC-κ 7.0 mg/L,sFLC-κ/λ比值0.020。免疫球蛋白定量IgG 54.23 g/L。骨髓细胞形态学检查示骨髓瘤细胞占比30.5%,荧光原位杂交(FISH)检测示t(14;16)异常核型。
根据《中国多发性骨髓瘤诊治指南(2024年修订)》[1]诊断标准,该患者被确诊为多发性骨髓瘤(MM)(IgG λ型,Durie-Salmon分期Ⅲ期A组,ISS分期Ⅲ期,R-ISS分期Ⅲ期),启动硼替佐米(Bortezomib)+地塞米松(Dexamethasone)+来那度胺(Lenalidomide)(VRD方案)化疗。
患者确诊MM 1个月后,自行乳房触诊,发现右乳一大小约1.5 cm×1.5 cm肿物。于2023年5月24日至乳腺外科门诊就诊,专科查体发现右乳外上象限一直径约2.0 cm×1.5 cm结节,边界欠清,活动度差,双侧乳房对称,未见皮肤静脉曲张,未见橘皮样改变及酒窝征,挤压双侧乳头,未见乳头溢液及分泌物,双腋下及锁骨上窝未触及肿大的淋巴结。否认乳腺癌家族史。正电子发射断层显像/计算机体层成像(PET/CT)示右乳头上方可见大小约1.5 cm×1.5 cm 结节,放射性摄取增高,最大标准化摄取值(SUV max)为 5.1。
因具有恶性肿瘤病史,故患者要求手术活检切除右乳肿物。2023年7月4日,患者收住乳腺外科病房。术前对乳腺肿物进行影像学评估,乳腺钼靶(图1A、1B)、彩色多普勒超声(图1C、1D)及核磁共振(图1E、1F)检查均提示BI-RADS 4C高度可疑的恶性病变。
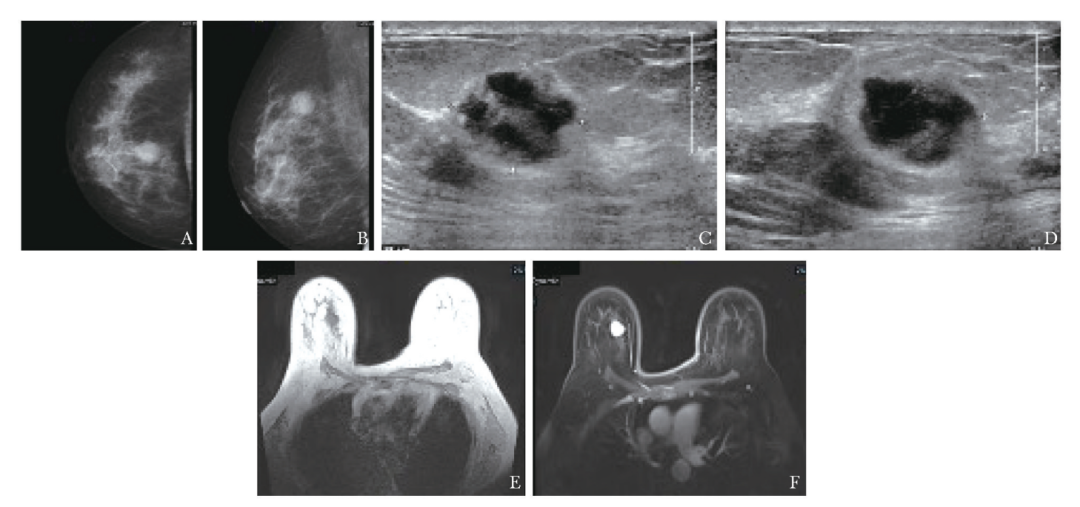
图1 患者乳腺肿物影像学检查结果(2023-05-24)
A.乳腺钼靶头尾位(CC)示右乳外上象限等密度肿块,大小约2.4 cm×2.2 cm,双乳散在点状钙化,BI-RADS 4C类;B.乳腺钼靶内外斜位(MLO)示相同病变;C、 D.乳腺超声示右乳11点钟方向距乳头6 cm处低回声肿块,大小约1.9 cm×2.0 cm×1.6 cm,形态不规则,边缘成角,周围伴高回声晕,内部回声呈片状及无回声区,彩色多普勒血流成像(CDFI)示实性成分内高速高阻穿支血流信号,BI-RADS 4C类;E.磁共振T1加权像;F.磁共振T1加权像联合横断面增强图像示右乳内上象限肿块样强化,BI-RADS 4C类
2023年7月5日,予患者择期行乳腺肿物切除活检术,石蜡病理结果回报浆细胞样形态的肿瘤细胞(图2A)。免疫组化染色排除乳腺癌的可能性,提示该肿物为浆细胞肿瘤。乳腺癌相关标志物检测结果均显示阴性,包括AE1/AE3(-)、CK14(-)、CK5/6(-)、E-Cadherin(-)、GATA3(-)、ER(-)、PR(-)、AR(-)和HER2(0)(图2B)。CD38(+)和CD138(+)染色呈阳性(图2C、2D),支持MM并发髓外浆细胞瘤(EMP)的诊断。
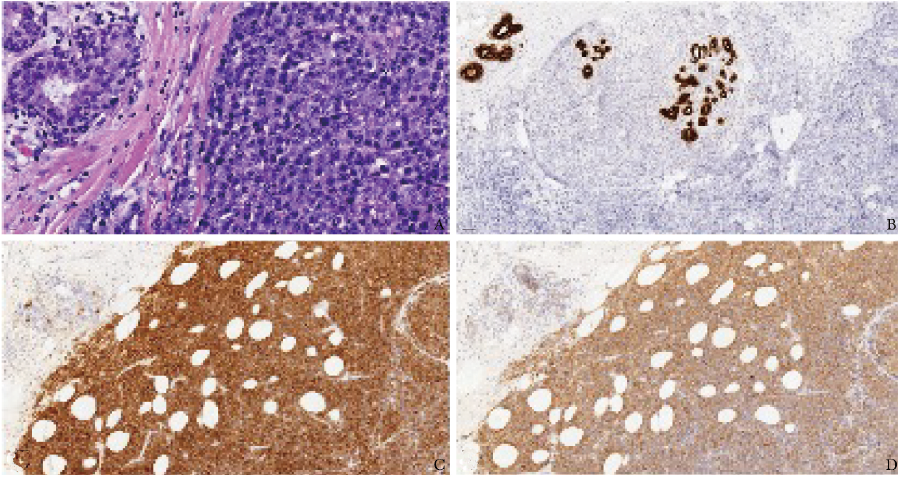
图2 患者乳腺肿物石蜡病理检查结果(2023-07-24)
A.乳腺肿物苏木精-伊红(HE)染色(×400):乳腺组织中密集的大核细胞,呈黏附性生长,核仁明显,呈浆母细胞样形态;B.乳腺肿物免疫组化染色(×100):乳腺癌相关标志物AE1/AE3(上皮组织来源抗体标志物)染色阴性;C.乳腺肿物免疫组化染色(×100):浆细胞特异性标志物CD38(+);D.乳腺肿物免疫组化染色(×100):浆细胞特异性标志物CD138(+)
目前针对MM的治疗方案主要为蛋白酶体抑制剂、免疫调节剂和地塞米松三药联合,相较于两药联合,其可提高患者的总生存期(OS)和无进展生存期(PFS)。若为高危/超高危患者(临床或遗传学),可考虑选择四药联合(VRd+Dara方案:代表药物为硼替佐米、来那度胺、地塞米松及达雷妥尤单抗)。
本例患者临床分期较晚,细胞遗传学示t(14;16),且并发乳腺EMP,为高危型患者,三程VRd治疗后调整治疗方案为达雷妥尤单抗(Daratumumab)+卡非佐米(Carfilzomib)+地塞米松(Dexamethasone)+顺铂(Cisplatin)+环磷酰胺(Cyclophosphamide)+依托泊苷(Etoposide)+多柔比星(Doxorubicin)(Dara+KRd-PACE方案)。
化疗期间,患者出现骨髓抑制(血小板减少和中性粒细胞缺乏)、感染性休克等不良反应。2023年12月21日,复查PET/CT示右肱骨旁代谢增高软组织病灶,大小约2.1 cm×1.8 cm,SUVmax 10.3,代谢肿瘤体积(MTV)35.6 cm2,考虑病情进展。随后,患者前往外院行干细胞采集,完成B细胞成熟抗原嵌合抗原受体T细胞(BCMA CART)回输。
2024年7月18日,复查PET/CT示右肱骨旁软组织病灶SUVmax 12→6.1,MTV 35.6 cm2→9.8 cm2,M蛋白阴性,血清免疫固定电泳(IFE)阳性,评估病情部分缓解(表1)。
表1 患者治疗方案、不良反应及随访结果

注:EMP(extramedullary plasmacytoma):髓外浆细胞瘤;WBC(white blood cell):白细胞;PLT(platelet):血小板;NEUT(neutrophil):中性粒细胞;CAR-T(chimeric antigen receptor T-cell therapy):嵌合抗原受体T细胞疗法;PET/CT(positron emission tomography/computed tomography):正电子发射断层显像/计算机体层成像;SUV(standardized uptake value):标准化摄取值;MTV(metabolic tumor volume):代谢肿瘤体积;IFE(immunofixation electrophoresis):免疫固定电泳
乳腺肿物是指乳腺组织内出现的异常增生或占位性病变,可分为良性或恶性。临床评估乳腺肿物需结合病史采集、体格检查、影像学及组织学检查进行系统性鉴别[2]。乳腺EMP作为乳腺肿物的病因极为罕见,现被视为MM的侵袭性亚型。国际骨髓瘤工作组(IMWG)数据显示,MM是常见的血液系统恶性肿瘤,2020年全球新发病例约18万例,死亡病例达12万例[3]。乳腺EMP是一种罕见的乳腺肿瘤,90%的EMP发生于头颈部,尤其是上呼吸道[4]。其他常见部位为皮肤和软组织,也可累及肝、脾、淋巴结、中枢神经系统和肺[5]。本文报告1例因持续性发热入院而确诊为MM的患者,化疗期间发现疑似乳腺癌的可触及肿物,经活检确诊为EMP。
目前EMP病因尚不明确,其发生可能与基因突变导致下游细胞信号通路异常有关。据报道,t(4;14)和t(14;16)在修订版国际分期系统(R-ISS)被视为高危细胞遗传学特征,提示携带这些基因突变的MM患者更易发生EMP[3]。EMP患者常见MAPK通路突变(80%)、TP53缺失(40%)及MYC/FGFR3/CCND2继发性易位(40%)[6]。此外,多种细胞因子和趋化因子异常,如细胞毒性T细胞和自然杀伤细胞抑制分子上调、趋化因子受体和黏附分子下调、CD81/CD82低表达以及CXCR4上调,可促进肿瘤细胞脱离骨髓微环境,通过免疫逃逸和迁移,导致髓外浸润[7]。
EMP的确切发病率尚不明确。既往文献显示,确诊MM的患者中仅5%~6% 发展为EMP。随着MM患者生存期的延长及PET/CT等先进技术的广泛应用,EMP的检出率逐渐升高[5]。具体而言,MM初诊和复发时髓外疾病的EMP检出率分别为1.75%~4.80%和3.40%~13.10%[6]。根据是否符合MM诊断标准,EMP可分为孤立性浆细胞瘤(SP)和髓外MM[8]。本病例符合髓外MM浸润标准。
此外,也有关于乳腺SP及复发性MM伴髓外浸润的病例报道,EMP的典型病例汇总详见表2[9-11]。
表2 EMP典型病例汇总
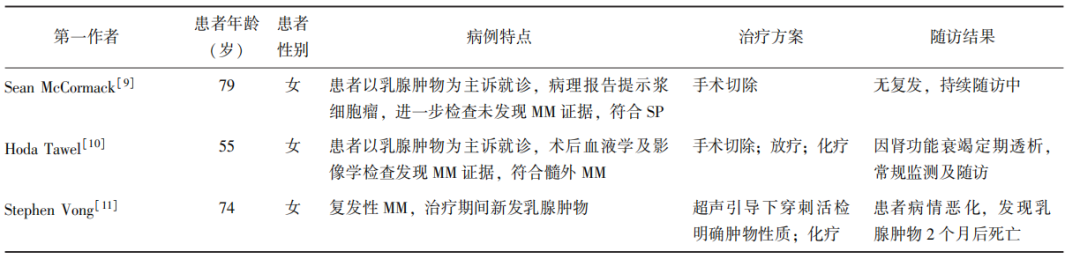
MM:多发性骨髓瘤;SP (solitary plasmacytoma):孤立性浆细胞瘤
对于EMP诊断,传统影像学检查存在明显局限性,且特异性较低,EMP呈现与原发性乳腺恶性肿瘤相似的临床特征。研究证实,18F-氟代脱氧葡萄糖(18F-FDG) PET/CT凭借其独特的代谢成像优势,已成为EMP诊断的首选影像学检查方法。对于MM,可通过血液学及骨髓检查发现其相关异常,PET/CT提示病灶FDG高摄取(SUVmax>肝脏背景值,即>2.0~2.5),结合病理学活检可明确诊断为EMP[12]。
值得注意的是,与MRI或CT相比,PET/CT在检测髓外浸润灶方面具有更高的敏感性,尤其对于体积较小(直径<2 cm)但代谢活跃的EMP病灶,其诊断效能显著优于全身MRI。本病例PET/CT检查结果具有重要诊断价值:患者已确诊MM,并发右乳肿物伴放射性摄取增高(SUVmax 5.1),这一典型表现为EMP诊断提供了重要依据。此外,PET/CT在预后评估方面也展现出潜在应用价值。研究显示,SUVmax>4.2提示EMP患者存在不良预后,表现为较短的PFS和OS[13-14]。
然而,在临床实践中,早期乳腺癌患者通常无需进行PET/CT检查,这在一定程度上增加了乳腺癌与EMP的影像学鉴别诊断难度。因此,需综合患者临床表现、实验室检查、影像学和组织学特征进行综合鉴别。临床表现方面,EMP患者多伴MM病史及贫血、肾功能异常等骨髓瘤相关表现,实验室检查可见M蛋白和游离轻链异常;而乳腺癌患者除存在乳腺肿物外,可见橘皮样变等皮肤改变,部分患者有家族史,肿瘤标志物CA15-3/CEA可能升高。影像学方面,乳腺癌钼靶多显示微钙化、毛刺征,超声可见边界不清的肿物;而EMP的常规影像学表现相对缺乏特异性。其确诊的金标准仍为病理学检查:EMP呈浆细胞样形态,表达CD38/CD138且显示轻链限制性;乳腺癌则表达上皮标志物(CK、GATA3)及激素受体。
EMP的发生被认为是MM不良预后的独立危险因素[8]。目前,建议通过穿刺或手术切除,对疑似髓外病变部位进行活检。EMP的治疗策略包括应用蛋白酶体抑制剂(如硼替佐米+卡非佐米)[15]、免疫调节药物(如来那度胺)、细胞毒性药物、免疫疗法[如达雷妥尤单抗、嵌合抗原受体T细胞疗法(CAR-T)]以及其他小分子靶向治疗药物。上述药物对EMP表现出不同程度的疗效[8],治疗目标为实现EMP最大程度缓解,改善终末器官并发症,预防早期复发和死亡,最终延长患者的生存期[3]。
本病例报告展示了1例罕见的乳腺EMP病例,强调结合病史全面评估肿瘤来源进行精准鉴别诊断的重要性,此方法对于指导恶性肿瘤治疗至关重要。然而,对于乳腺EMP,超声和钼靶等常规影像学检查通常缺乏特异性,可能导致其被误诊为原发性乳腺肿瘤。PET/CT可为EMP的鉴别诊断提供参考依据,但EMP的最终确诊仍依赖骨髓细胞学检查及乳腺肿物活检的病理诊断。
注:本病例报告已通过北京协和医院伦理委员会审批(审批号:K23C4016),且征得患者知情同意。
作者贡献
刘语涵负责收集病例及影像学资料、查阅文献、撰写论文初稿及修订论文;赫泽成、王铭悦负责查阅文献及修订论文;朗洁负责收集病理诊断资料;周易冬负责修订论文;王常珺负责修订及审校论文。
参考文献
[1]中国医师协会血液科医师分会, 中华医学会血液学分会. 中国多发性骨髓瘤诊治指南 (2024年修订)[J]. 中华内科杂志, 2024, 63(12): 1186-1195.
[2]Singh H, Sethi S, Raber M, et al. Errors in cancer diagnosis: current understanding and future directions[J]. J Clin Oncol, 2007, 25(31): 5009-5018.
[3]Dimopoulos M A, Moreau P, Terpos E, et al. Multiple myeloma: EHA-ESMO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2021, 32(3): 309-322.
[4]Lopes Da Silva R. Extramedullary plasmacytoma of the small intestine: clinical features, diagnosis and treatment[J]. J Dig Dis, 2012, 13(1): 10-18.
[5]Bladé J, Beksac M, Caers J, et al. Extramedullary disease in multiple myeloma: a systematic literature review[J]. Blood Cancer J, 2022, 12(3): 45.
[6]Rasche L, Schinke C, Maura F, et al. The spatio-temporal evolution of multiple myeloma from baseline to relapse-refractory states[J]. Nat Commun, 2022, 13(1): 4517.
[7]Bansal R, Rakshit S, Kumar S. Extramedullary disease in multiple myeloma[J]. Blood Cancer J, 2021, 11(9): 161.
[8]Rosiñol L, Beksac M, Zamagni E, et al. Expert review on soft-tissue plasmacytomas in multiple myeloma: definition, disease assessment and treatment considerations[J]. Br J Haematol, 2021, 194(3): 496-507.
[9]McCormack S, Hamad E, Hamad A. Solitary plasmacytoma of the breast: a case of an uncommon breast neoplasm[J]. Case Rep Hematol, 2023, 2023: 9622042.
[10]Tawel H, Hasen Y, Arrgebe H, et al. Breast plasmacytoma as extra-medullary lesion of multiple myeloma: a case report[J]. J Investig Med High Impact Case Rep, 2022, 10: 23247096221111773.
[11]Vong S, Navarro S M, Darrow M, et al. Extramedullary plasmacytoma of the breast in a patient with multiple myeloma[J]. J Radiol Case Rep, 2020, 14(12): 14-23.
[12]Varettoni M, Corso A, Pica G, et al. Incidence, presenting features and outcome of extramedullary disease in multiple myeloma: a longitudinal study on 1003 consecutive patients[J]. Ann Oncol, 2010, 21(2): 325-330.
[13]Cavo M, Terpos E, Nanni C, et al. Role of 18F-FDG PET/CT in the diagnosis and management of multiple myeloma and other plasma cell disorders: a consensus statement by the International Myeloma Working Group[J]. Lancet Oncol, 2017, 18(4): e206-e217.
[14]Zamagni E, Patriarca F, Nanni C, et al. Prognostic relevance of 18-F FDG PET/CT in newly diagnosed multiple myeloma patients treated with up-front autologous transplantation[J]. Blood, 2011, 118(23): 5989-5995.
[15]San Miguel J F, Schlag R, Khuageva N K, et al. Bortezomib plus melphalan and prednisone for initial treatment of multiple myeloma[J]. N Engl J Med, 2008, 359(9): 906-917.


